近年來全球新藥開發的趨勢之一為朝向與「伴隨式診斷(companion diagnostics)」相結合來發展,這個發展趨勢已使得體外診斷(In Vitro Diagnostic, IVD)在整個醫療照護的環節中增加了相當的權重,而伴隨式診斷更被美國FDA認為是「個人化醫療(Personalized Medicine)」之核心(註1)。
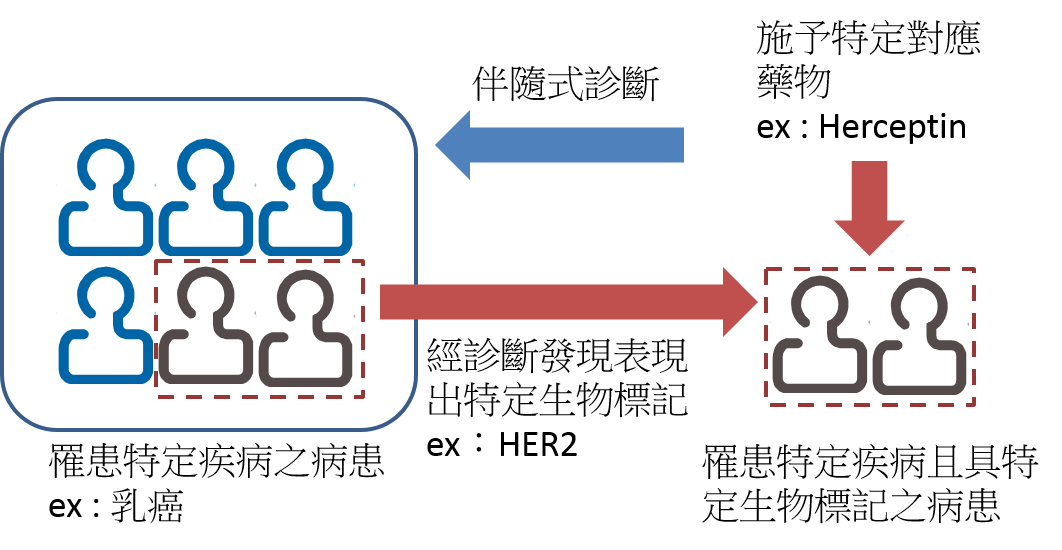
根據美國FDA於2011年7月所發布的「體外搭配診斷裝置指引草案(Draft of In Vitro Companion Diagnostic Devices guidance)」指出,伴隨式診斷裝置係指一種可提供對應藥物必要的安全性和有效性資訊之裝置。伴隨式診斷裝置的特點在於:(1)可辨識出對特定藥物最有可能受益之病患,(2)可辨識出病患可能因使用特定藥物而增加副作用的風險,以及(3)可監測調整治療方式(例如療程、劑量、中斷治療等)之反應以達到增進安全性或有效性之目的(註2)。簡而言之,透過伴隨式診斷將可讓對的藥物與劑量施予對的病患。以乳癌治療藥物HerceptinR為例,其伴隨式診斷之生物標記為人類上皮生長因子接受器2(Human Epidermal Growth Factor Receptor-2, HER2),在過去研究中發現約20~30%的乳癌患者其腫瘤細胞有HER2過度表現的現象,且可作為乳癌治療的預後因子之ㄧ。HerceptinR是ㄧ款以HER2為標的之單株抗體藥物,其治療在HER2過度表現之轉移性乳癌末期患者,可將整體存活期(Overall Survival)從20.3個月增加到25.1個月(註3),HerceptinR現已成為治療HER2過度表現乳癌患者之重要藥品。換句話說,在罹患乳癌的病患中,經診斷發現其中具有HER2生物標記過度表現的患者,加以施予HerceptinR藥物預期將會有更佳的治療效果(圖1)。
基於伴隨式診斷具有降低無效醫療的潛力,並進而可能降低醫療費用支出,因此,美國與歐盟紛紛開始鼓勵新藥開發時可一併進行伴隨式診斷之發展,期能更為正確地篩選出目標病患族群,助於藥品開發的時程縮短與成本降低;例如Roche的ZelborafR治療BRAF V600E突變之黑色素瘤與Pfizer的XalkoriR治療EML4-ALK突變之非小細胞肺癌這兩個藥物的開發時間僅約為5~6年,並分別在送交FDA查驗登記後約3.6與4.9月即與各自的伴隨式診斷產品一同獲得核准(註4)。
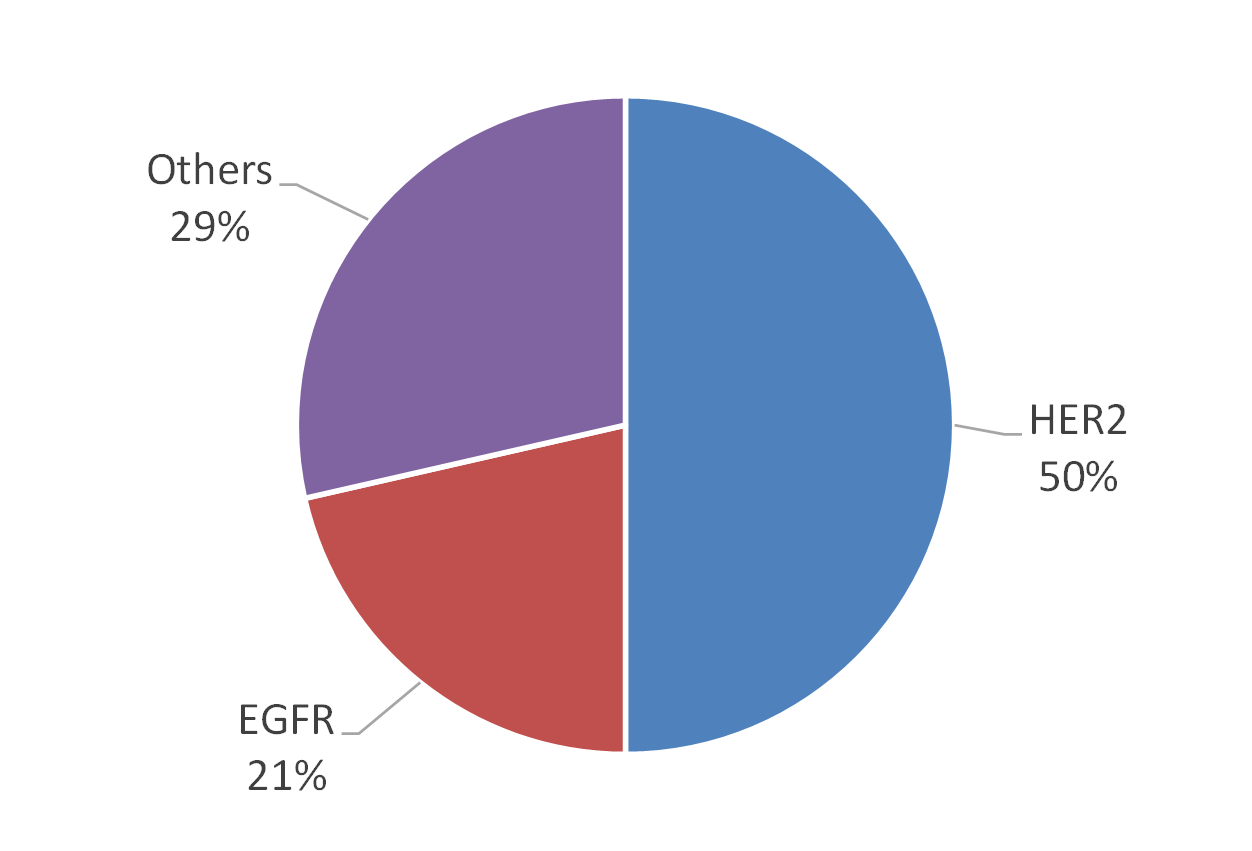
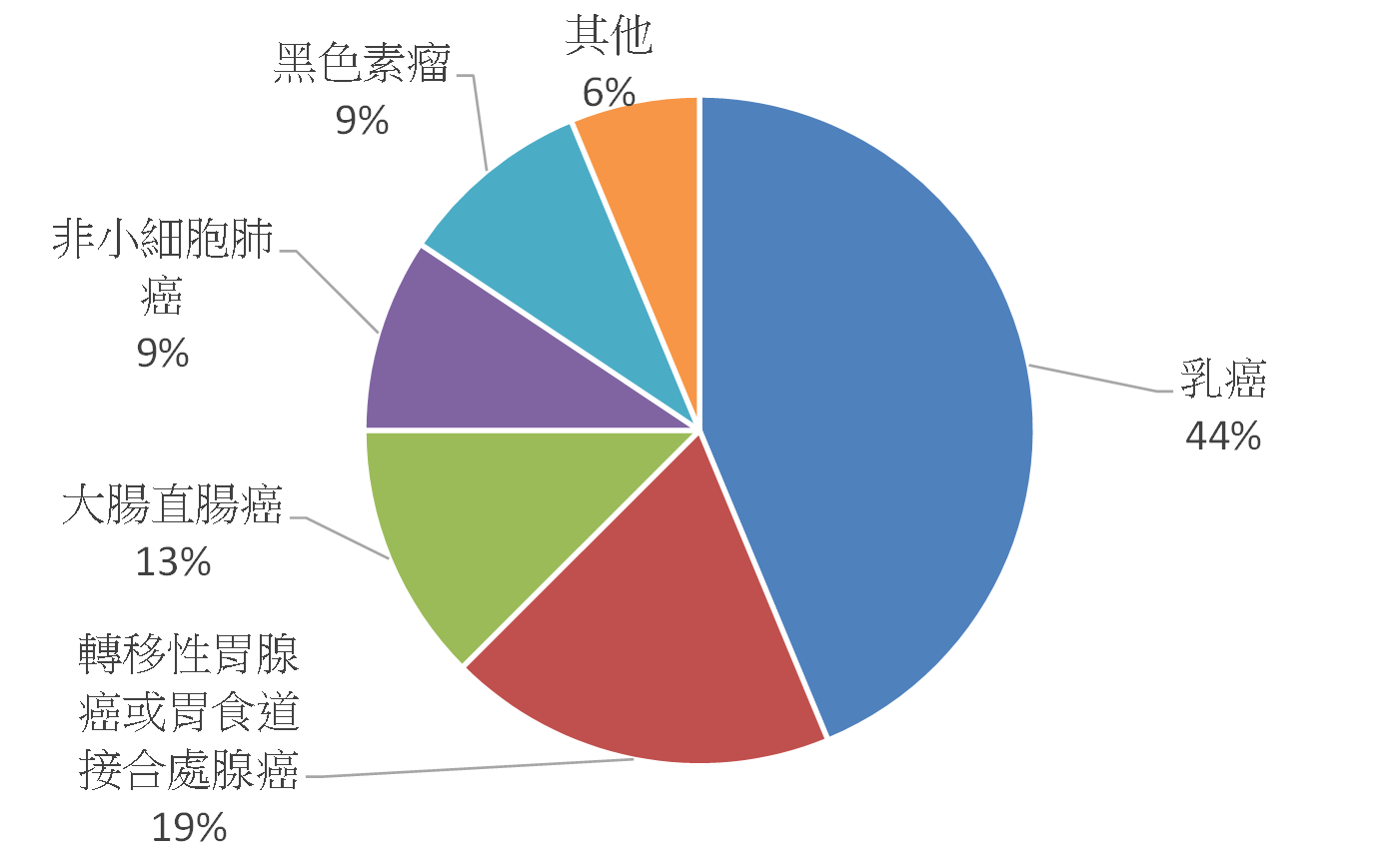
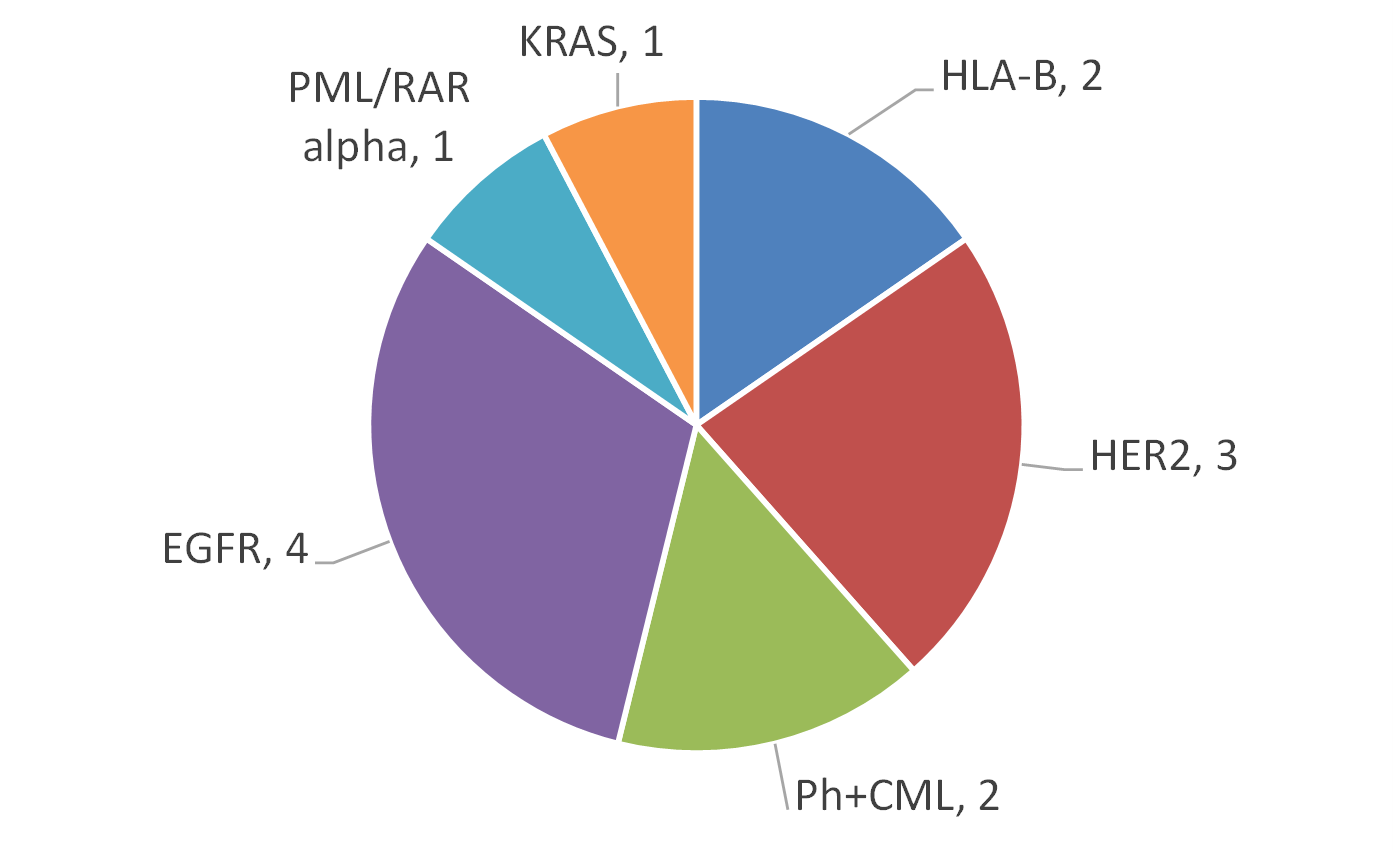
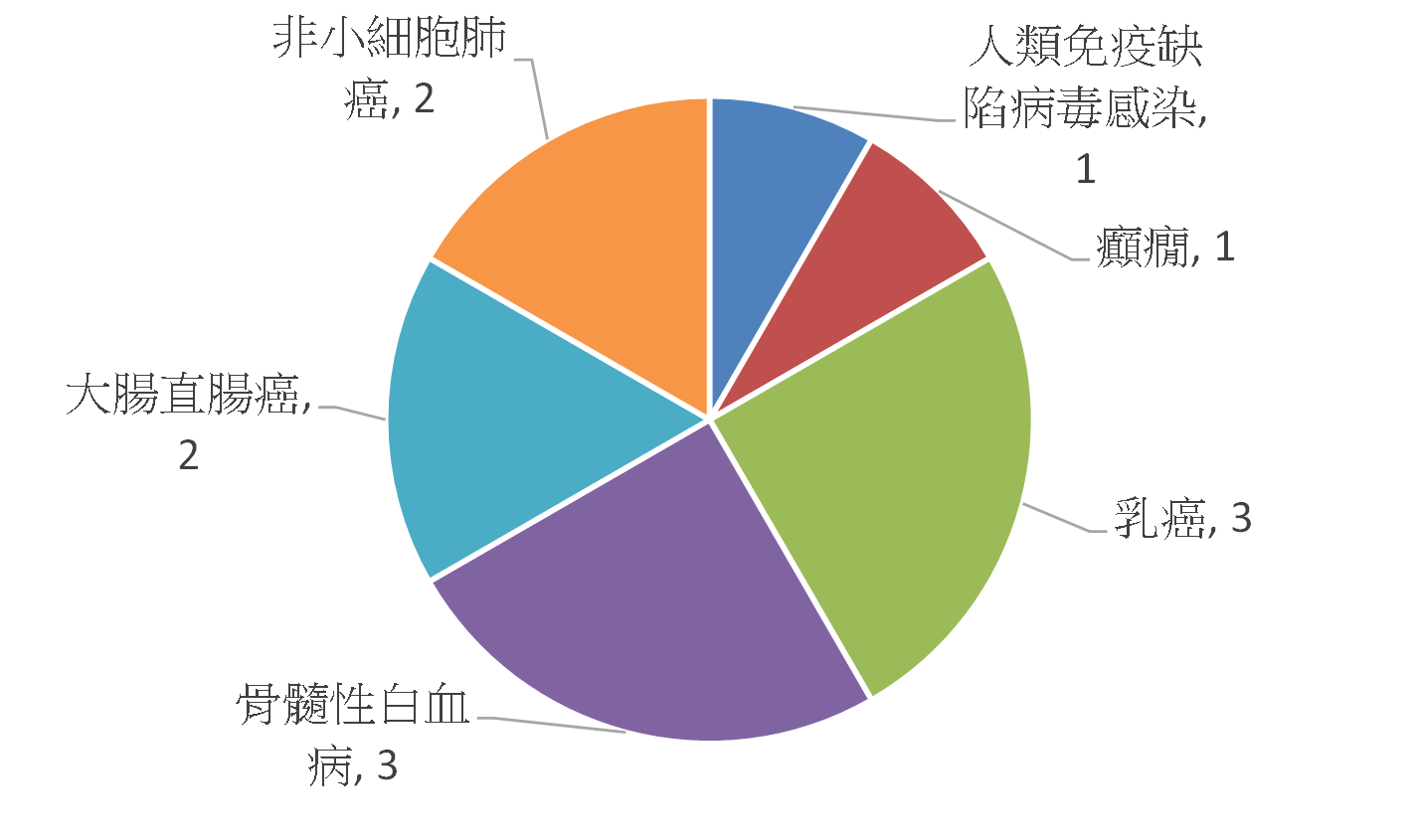
若從市場來看,據BCC Research調查指出,全球伴隨式診斷市場在2012年約為11億美元,預計到2018年可達35億美元,年複合成長率(CAGR)為21.3%(註5),全球伴隨式診斷市場的分佈以美國佔最大宗約64%,其次為歐洲約28%(註6)。美國FDA截至2014年5月已核准26項藥品與伴隨式診斷之組合(註7),共計有17款產品。目前美國FDA所通過的伴隨式診斷所檢測之生物標記以HER2為最大宗,共7項(佔50%),其次為EGFR(Epidermal Growth Factor Receptor),共3項(佔21%)(圖2)。而藥品與伴隨式診斷產品之組合所對應之疾病,以乳癌為最大宗,佔44%,其次為轉移性胃腺癌或胃食道接合處腺癌,佔19%,次之為大腸直腸癌,佔13%(圖3)。在歐盟2013年共列出12款藥品需提供伴隨式診斷(註8),其對應之生物標記以EGFR為最大宗,共3款需求藥品,其次為HER2,共2款需求藥品(圖4)。該12款藥品的適應症亦以癌症為主,共10款藥品(圖5)。從上述可以發現目前以癌症治療藥物為伴隨式診斷開發之主要標的,其中又以HER2與EGFR為最熱門的生物標記,然現在以HER2和EGFR為標的之伴隨式診斷,已有相當多已上市或發展中產品,後進廠商可能可朝向不同生物標記或藥品組合的方向去發展。
在台灣目前已投入伴隨式診斷發展之廠商有創源生物科技股份有限公司、基龍米克斯生物科技股份有限公司與普生股份有限公司。創源生技於2012年和Novartis合作進行伴隨式診斷之開發,而基龍米克斯則引進Qiagen的EGFR診斷產品,並曾在2011年進行「建立台灣轉移性大腸直腸癌病人KRAS、BRAF基因突變熱點與EGFR表現量及Cetuximab標靶藥物療效分析工具建立」之研發計畫。普生則和美國GDC分子診斷公司(Genetics Development Corporation)合作開發HER2 乳癌分子診斷,預期以此產品進入伴隨式診斷之領域。
隨著診斷技術的進步與生物標記的建立,加上國際醫藥主要國家法規主管機關的政策傾向,已使得新藥開發結合伴隨式診斷成為現今新藥開發的趨勢之一,同時亦是體外診斷廠商的新商業契機。此外,伴隨式診斷亦意味著,大藥廠不再只專注在重磅型(Blockbuster)藥物,而將同時朝向針對基因型差異之特定病患族群的藥物模式來發展。對於體外診斷廠商而言,若能把握機會去和標靶藥物新藥廠商進行合作開發,不論是在生物標記、診斷工具的開發或檢測技術平台的發展,會有機會隨著藥品的全球佈局而進軍國際市場,將有助於擴大市場範圍及營收表現。而隨著伴隨式診斷的發展,預期將使得個人化醫療的實施會更為普遍出現在ㄧ般醫療照護中。
(註1)Biomarkers and beyond: Companion diagnostics regulation- FDA’s position, Peter Charlish;根據美國國家科學院(National Academy of Sciences)指出「個人化醫療(Personalized Medicine)」係指利用基因體、表觀基因體、暴露和其它資訊去定義個體疾病的模式,使得有潛力可對於該個體有更好的治療
(註2)Draft of In Vitro Companion Diagnostic Devices guidance, FDA
(註3)Trastuzumab- Mechanism of Action and Use in Clinical Practice, N Engl J Med2007(357), Clifford A. Hudis
(註4)Xalkori and Zelboraf- the highs and lows of commercializing targeted cancer drugs, Jessica Merrill
(註5)Companion Diagnostics: Technologies and Markets, BCC Research
(註6)US Companion Diagnostics Market Trends and Insights, Frost&Sullivan
(註7)Companion Diagnostic Devices: In vitro and Imaging Tools (最後瀏覽日期2014/06/23),以一款藥物配一款診斷產品之組合為單位計算
(註8)Western European Companion Diagnostics Market, Frost&Sullivan
(註9)以藥品-伴隨式診斷產品-疾病 之組合為單位計算
(註10)有款藥品VectibixR,需求生物標記HER2與KRAS之診斷,故在本圖合計為13款藥品
文章來源:宇智顧問股份有限公司