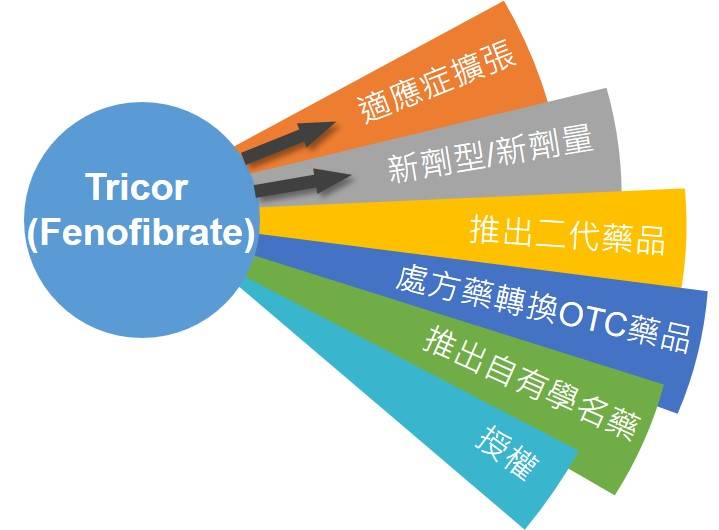
藥品生命週期管理策略被藥廠視為可延續產品生命之重要手段,並期待藉以極大化該產品的市場利益。常見的生命週期管理策略包含有適應症擴張、新劑型、推出二代藥品,處方藥轉換OTC藥品、推出自有學名藥和授權等。在本篇所提到的降血脂藥物Fenofibrate,為將新劑型/新劑量之策略來延長產品生命發揮得淋漓盡致之實例。
 係屬於纖維酸(Fibrate)類藥物,Fenofibrate的活性代謝物Fenofibric acid可活化peroxisome proliferator activated receptor alpha(PPARα),而PPARα可活化脂肪水解酶(lipoprotein lipase)及降低apoprotein C3的量以增加三酸甘油脂(triglyceride)的脂肪分解(lipolysis)和排除(elimination)作用,常用來治療高血脂症(Hyperlipidemia)(註1) ,經研究顯示可降低三酸甘油脂濃度20~50%、低密度脂蛋白(LDL)5~20%及提升高密度脂蛋白(HDL)10~35%(註2)。
係屬於纖維酸(Fibrate)類藥物,Fenofibrate的活性代謝物Fenofibric acid可活化peroxisome proliferator activated receptor alpha(PPARα),而PPARα可活化脂肪水解酶(lipoprotein lipase)及降低apoprotein C3的量以增加三酸甘油脂(triglyceride)的脂肪分解(lipolysis)和排除(elimination)作用,常用來治療高血脂症(Hyperlipidemia)(註1) ,經研究顯示可降低三酸甘油脂濃度20~50%、低密度脂蛋白(LDL)5~20%及提升高密度脂蛋白(HDL)10~35%(註2)。
Fenofibrate最早由Fournier Laboratories公司(註3)在1980年代所開發出,在1984年新藥查驗登記(NDA)被FDA退件,理由為Fenofibrate臨床試驗終點為代理終點(surrogate endpoint)而非對於心血管治療的最終結果,Fenofibrate於1993年因可降低三酸甘油脂的效果方被核准(註4),然本藥品當時並未在美國上市,而後授權給Abbott藥廠,才於1998年以Tricor-1品牌上市。
在2000年2月,Novopharm提出Tricor-1學名藥的上市申請(ANDA),Abbott隨後依據Hatch-Waxman法案中Paragraph IV程序提出專利訴訟並獲得30個月FDA暫緩審查。在這30個月中,Abbott將Fenofibrate研磨成微小粒以提升其溶解速率,進而提高生體可用率(bioavailability)使得劑量得以降低(註5)。Abbott於18個月後,以Tricor-2之54與164mg的劑量與Tricor-1之134與200mg的劑量具備生物相等性(bioequivalence)向FDA提出藥證申請並獲准。Abbott隨即在市場上停售Tricor-1,並改銷售Tricor-2,使得Tricor-1的學名藥缺少所參考之原廠藥品,因劑量之差異而無法藉由藥師將原廠藥處方替換為學名藥(註6)。Abbott的策略使得Tricor-2在被核准後6個月,成功替換原本Tricor-1 97%的市場(註7,8)。
同樣的策略也運用在Tricor-2與Tricor-3的轉換。Teva與Impax Laboratories於2002年底提出Tricor-2學名藥的ANDA。Abbott同樣也依據Hatch-Waxman法案所載之程序提出專利訴訟以取得30個月FDA暫緩審查的時間。在這30個月中,Abbott運用Elan的奈米結晶體(Nanocrystal)技術,將Fenofibrate的粒徑再下降至小於400奈米以提高生體可用率並更進一步降低劑量(註9),除此之外Abbott更宣稱Tricor-3無需搭配食物而可在任何時間點服用來增進便利性。在2004年,Abbott再次以Tricor-3之48與145mg的劑量與Tricor-1具備生物相等性而獲FDA核准。Tricor-3上市後Abbott以相同的市場操作手法,使得Tricor-2學名藥因劑量之差異而無法藉由藥師將原廠藥處方替換為學名藥。在Tricor-3被核準後70天,原先Tricor-2的70%病患成功替換成Tricor-3,到了2005年Tricor-3的處方量已占據了Fenofibrate整體處方量的96%(註10)。
在2007年,Abbott在Teva送Tricor-3學名藥的ANDA之前先提出活性成分為Fenofibric acid(註11)之品牌藥Trilipix之NDA。Abbott同樣藉著證實Trilipix(Fenofibric acid)與Tricor-1(Fenofibrate)之間的生物相等性,並再加上合併Statin類藥物療法以HDL、LDL和三酸甘油脂為替代終點之臨床試驗來證實Trilipix之效果。FDA於2008年核准,並給予因新成分新藥(New chemical entity, NCE)3年的市場獨佔權(註12)。因此在2009年Trilipix已占據了77%原先Fenofibrate藥品之處方量(註13)(圖1),直到2011年,Abbott仍持續盤據的Fenofibrate/Fenofibric acid藥品市場。
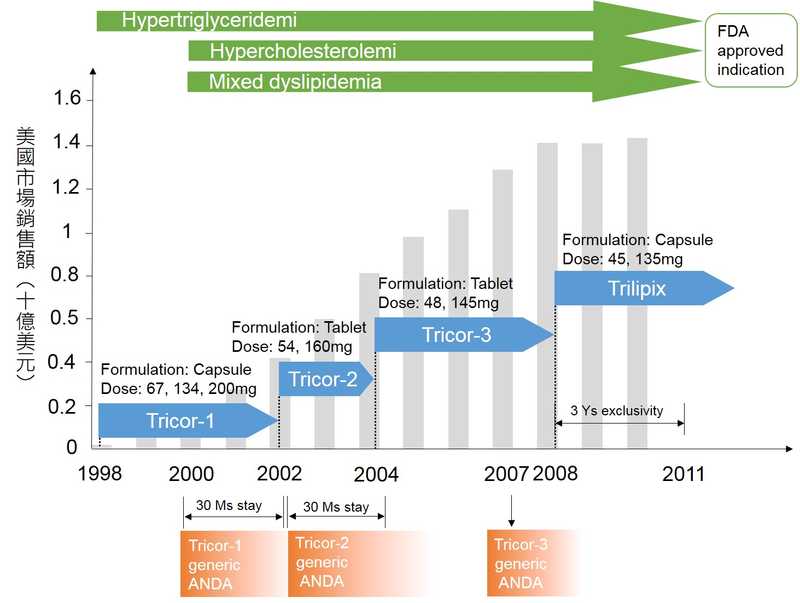
Abbott善用新劑型及法規對於生物相等性之要求成功延遲學名藥進入市場的時間達約7年,並成功運用生物相等性及使用替代終點之臨床試驗,進一步延伸保護其市場利益3年,為Abbott從中獲取巨大利益。2006年Abbott之Fenofibrate在美國市場銷售額約達10億美元,2008到2011年之間Fenofibrate/Fenofibric acid藥品每年銷售額約達14億美元之譜(圖1)。值得注意的是,美國藥品市場原廠品牌藥與學名藥間的轉換仰賴於藥師、醫師、保險單位與藥品給付管理公司(Pharmacy benefit management, PBM)自發性替換,而非學名藥廠在美國的銷售團隊推動(註16),此亦為Abbott對於Fenofibrate新劑型/新劑量策略之成功關鍵因素之一。此外Abbott的Fenofibrate除透過新劑型/新劑量阻絕學名藥進入市場之外,亦透過適應症擴張,從原適應症高三酸甘油脂症擴張至高膽固醇血症(Hypercholesterolemia)與混合型血脂症(Mixed dyslipidemia)來擴大市場。
相較於Abbott在Fenofibrate藥品的成功,對於病患及保險給付單位而言,延遲學名藥進入市場會造成龐大的醫療支出負擔,預計如Fenofibrate學名藥進入市場,每年醫療支出可節省約7億美元。Abbott也因為對於Fenofibrate藥品一連串類似的操作策略遭遇學名藥廠、藥品經銷商與病患提出違反公平競爭(anti-trust)之訴訟,在2008年美國相關訴訟遍及19州,而Abbott後續對於這些訴訟之和解或賠償金額超過3億美元(註17,18)。
從Abbott的降血脂藥物Fenofibrate的操作策略可知,一項執行良好的藥品生命週期管理策略有賴於對於市場與法規通徹的了解及相關團隊通力的合作,雖然隨著法規的修改與醫療照護系統的改變,像是Fenofibrate的案例未必能完美複製,然我們可知藥品生命週期管理策略會是大藥廠延續其市場利益之利器,而對於中小型藥廠與生技公司而言,透過技術的合作切入重磅藥經濟生命的延長,亦會是可切入的利基。
(註1)Mechanism of Action of Fibrates on Lipid and Lipoprotein Metabolism, Stael et al.
(註2)高血脂肪治手冊,行政院衛生署國民健康局
(註3)Fournier Laboratories於2005年被Solvay Pharmaceuticals併購,2009年Solvay Pharmaceuticals被Abbott Laboratories(now AbbVie)併購
(註4)最初被核准時的品牌名稱為Lipidil,劑量為100mg,劑型為膠囊
(註5,9)歐美特色藥廠延續產品生命週期的手段與商機,顧曼芹
(註6)Why Are Tricor and Trilipix So Expensive? (最後瀏覽日期2015/07/20)
(註7,10,13,14,16,17)How Abbott’s Fenofibrate Franchise Avoided Generic Competition, Downing et al.
(註8,12,18)Abbott Reformulation a Bad Deal (最後瀏覽日期2015/07/20)
(註11)Fenofibric acid為Fenofibrate之活性代謝物
(註15)FDA
文章來源:宇智顧問股份有限公司