胰臟癌在癌症案例中雖然僅佔3.2%,但在癌症致死的相關性,卻排名第三。我們不乏在新聞媒體看到因為胰臟癌,沒什麼太長的時間可以做治療,導致生命快速逝去。它之所以這麼難治療,是因為腫瘤傾向發展成為激進性的基因突變,能對抗很多藥物。此外,在診斷上也常是在擴散到身體其他部位時才發現,已經太遲了。
生醫人很久沒有刊登關於新研究的文章。主要有感於很多研究重複性高,缺乏驚奇感,同時也在尋求下一個階段文章的定位。然而,這篇胰臟癌治療研究的文章內容很值得介紹,不只是因為是胰臟癌這個疾病,而是原始文章雖然是簡要的新聞稿形式,卻說明了臨床前研究的流程,以及未來研究的方向。這是實驗室階段的研究,很標準的類型且讓人期待的。很建議大家一起來了解。
胰臟癌為什麼難治療?
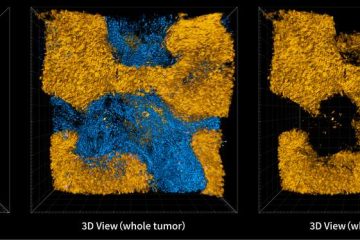
這篇胰臟癌的研究,發表在Nature Biomedical Engineering。該篇研究開發一種凝膠形式的放射性植入物,能合併放射治療和化療,消融小鼠體內80%的腫瘤,且在各種癌症模型上獲得驗證。過去這樣治療胰臟癌的研究,大多數只能停止腫瘤的生長,但沒辦法讓腫瘤消失;而這篇研究讓人興奮的地方,是結果顯示能夠在各種實驗模型,包含大家認為最難治療的胰臟癌類型,消除80%的腫瘤。
現有的治療
先來聊一下現有的治療。目前領先的治療是合併化療和針對腫瘤的放射線治療。化療的功能是將細胞維持在易受到輻射影響的再生階段。接著,如果放射線能達到腫瘤位置,就有機會能消除腫瘤。注意,前題是放射線能夠到達腫瘤,不然沒有什麼效力。所以這裡的挑戰就在如何能將放射線帶到目標腫瘤位置,同時不影響周遭的健康組織。(事實上,已經有很多類似的研究,例如將放射性同位素與特定藥物結合,將同位素帶到腫瘤位置;或者開發特定的化學物質,能夠結合在腫瘤細胞上,將放射性同位素與這種華學物質結合,就是很好的放射治療。)。這篇文章有提到,曾有人將放射物質包裹在『鈦』材質內,直接放到腫瘤內。但是,除了Gamma射線,鈦能阻擋幾乎所有的放射線。而Gamma射線離開腫瘤,能走很遠,停留在身體內的時間很短。
注射放射性植入物
那麼,要怎麼讓放射線能直攻腫瘤?這篇研究提到的植入物又是怎麼運作?
同樣是也有傳統的化療,再加上新的方法對腫瘤做放射治療。而這個新方法,有別於傳統的放射線,從患者體外穿過健康的組織進到身體;這個新方法是將有放射性的碘-131(Iodine–131) ,包裹在凝膠材料內,然後注射到腫瘤位置;放射性衰減完之後,包覆它的凝膠材質會慢慢被生物組織吸收。這個凝膠般的物質是由彈性蛋白樣多肽 (elastin-like polypeptides,ELPs)加上特製的物質製成。ELPs是一種胺基酸 (Amino acid) 鍵結在一起的合成鍊。ELPs在室溫是液態,但到生物體內溫度較高的環境,則變成較穩定的凝膠。當這種材質和放射性物質一起注射到腫瘤內,ELPs會包覆這些放射性物質。在這篇研究中,選擇數十年內廣泛被使用的放射性同位素碘-131,因為醫師對它的生物效能有相當的了解。ELPs包覆碘-131,能防止它外洩到生物體外。碘-131會釋放β 射線,能穿透生物膠且將能量附著到腫瘤上,而不會到周遭的組織上。隨著時間過去,碘-131衰減,形成無害的氙氣(xenon);接下來,ELP會降解到它的組成成分胺基酸,然後被身體吸收。事實上這個過程中,碘-131釋放的β 射線,也有助於增進ELP生物膠的穩定性。讓ELP形成的碘-131儲存體能持久。因此,只有β 射線都釋放完之後,ELP 才會降解。
化療
那麼化療藥呢?這篇研究實驗的化療藥是常見的紫杉醇 (paclitaxel)。
小鼠實驗結果
綜合以上,碘-131+生物凝膠+紫杉醇,治療最難治又惡名昭彰的胰臟癌。實驗了多種的胰臟癌類型。這樣的新治療方法證實有協同(synergistic)治療的效果。研究員是將這種凝膠注射到小鼠皮膚下的腫瘤,這些腫瘤是由胰臟癌各種突變產生的。當然也實驗治療了就在胰臟部位的腫瘤,發現治療難上許多。
整體而言,這篇研究在所有的模型顯示100%的反應,在80%的時間內,3/4的腫瘤消失。而且,除了單獨執行化療引起的副作用,沒有立即明顯的副作用。
將放射線直接帶入腫瘤,當然比從體外給予放射線束來的更精準,同時不會傷到健康的組織。這篇研究聽起來相當振奮人心,但仍在非常早期的研究階段,也就是小動物的實驗階段。研究員說明接下來要進入大動物的實驗,在這個階段必須要能證明這樣的新方法,能夠用現有的臨床工具和內視鏡等技術準確地執行。如果能成功,才會期待有Phase 1的人類臨床實驗。
這篇是很典型的臨床前研究。提到了原理、進行的實驗、動物實驗,以及未來進行大動物實驗,需要克服哪些問題。雖然簡短,卻依稀清楚勾勒出臨床前研究的部分輪廓。
文章參考: Duke University