新藥開發常被視為一國生物科技發展之重要指標之一,許多致力於發展生物科技的國家視新藥開發為重要之成果展現。台灣投入生物科技的發展已約三十餘年,近幾年逐漸開始看到成果,新藥開發公司在資本市場亦已相當活躍,然可惜的是台灣目前尚無自主開發的新藥獲FDA審查核准上市之案例。截至2013年4月,台灣廠商的新藥已有96款在全球各地含台灣在內進行臨床試驗 ,其中最大宗在臨床試驗二期(Phase 2),共計51款(佔53.1%),其次為在臨床試驗三期(Phase 3)22款與一期(Phase 1)的17款藥品,另有6款送交我國查驗登記(註1),預計近幾年為是否有成功開發新藥的關鍵期,也將會是台灣生技產業發展的重要里程碑。
在新藥開發中,不論作為內部評估或外部分析,新藥開發成功率是很重要之考量因子。關於新藥開發的成功率,今年有發表一篇最新統計調查數據(註2),其統計2003年到2011年間,在臨床試驗階段藥品共4,451款,涵蓋835間公司,其在每一臨床試驗階段成功進入下一期與最終獲FDA審查(NDA/BLA)核准上市之比例。
從整體數據觀之,在Phase 1藥品成功進入Phase 2(註3)的機率為64.5%,而最終成功獲FDA核准上市的機率為10.4%。在Phase 2藥品成功進入Phase 3(註4)的機率為32.4%,最終成功獲FDA核准上市的機率為16.2%。在Phase 3藥品成功進入NDA/BLA的機率為50%,而獲FDA審查核准的機率為83.2%。
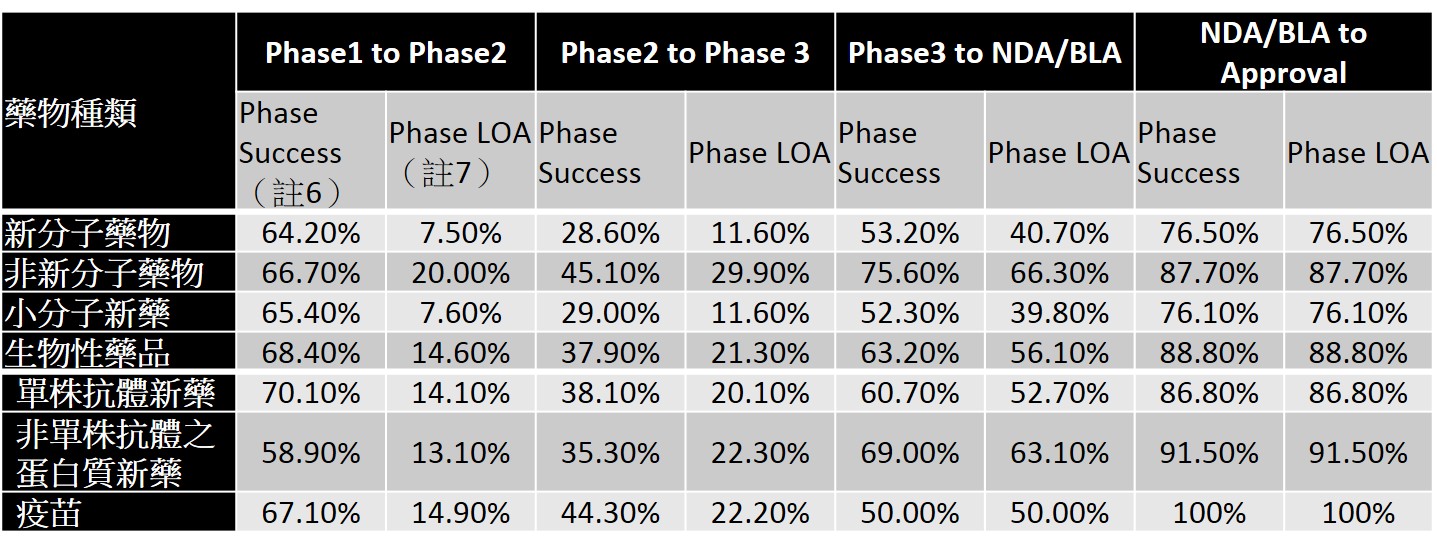
以藥品種類觀之,如表1所示,新分子藥物(new molecular entities, NMEs)在臨床各階段的成功機率與最終獲FDA核准通過的機率皆低於非新分子藥物(non-NMEs),因此相對而言,發展新劑型新藥與組合藥物的風險性較低。小分子新藥(small molecule NMEs)在臨床各階段的成功機率與最終獲FDA核准通過的機率皆低於生物性藥品(biologics)(註5),尤其在Phase 1與Phase 2新藥最後獲得審查通過的機率差約兩倍(7.6% vs 14.6%;11.6% vs 21.3%)。在生物性藥品中又以疫苗有較高的開發成功機率,送交查驗登記後幾乎等同可獲審查通過。
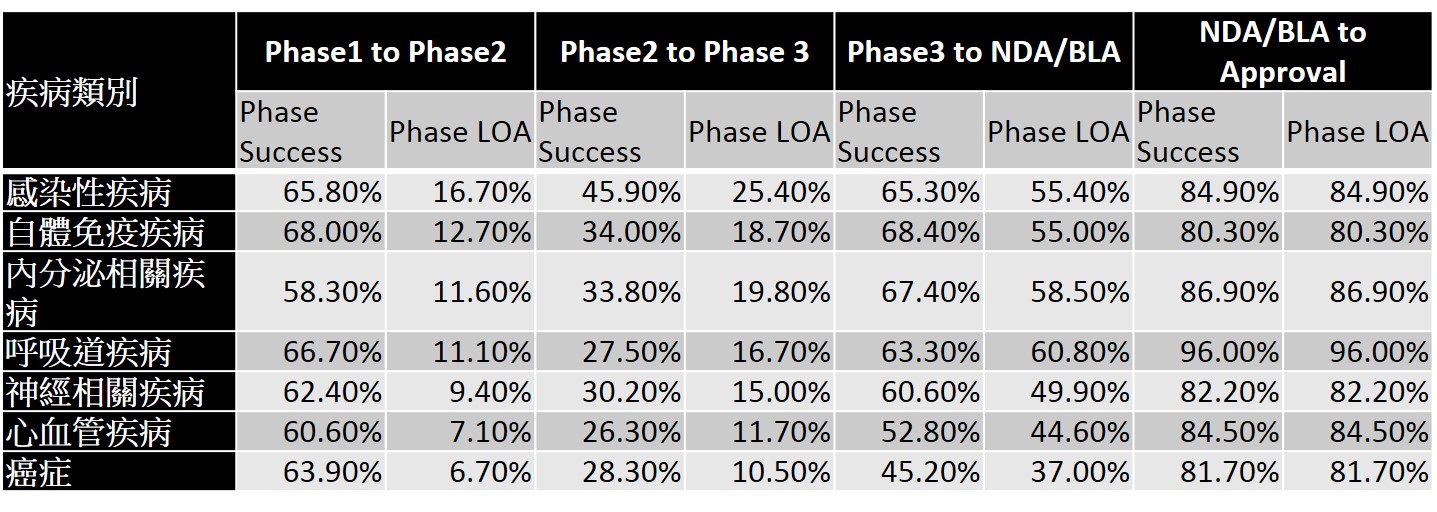
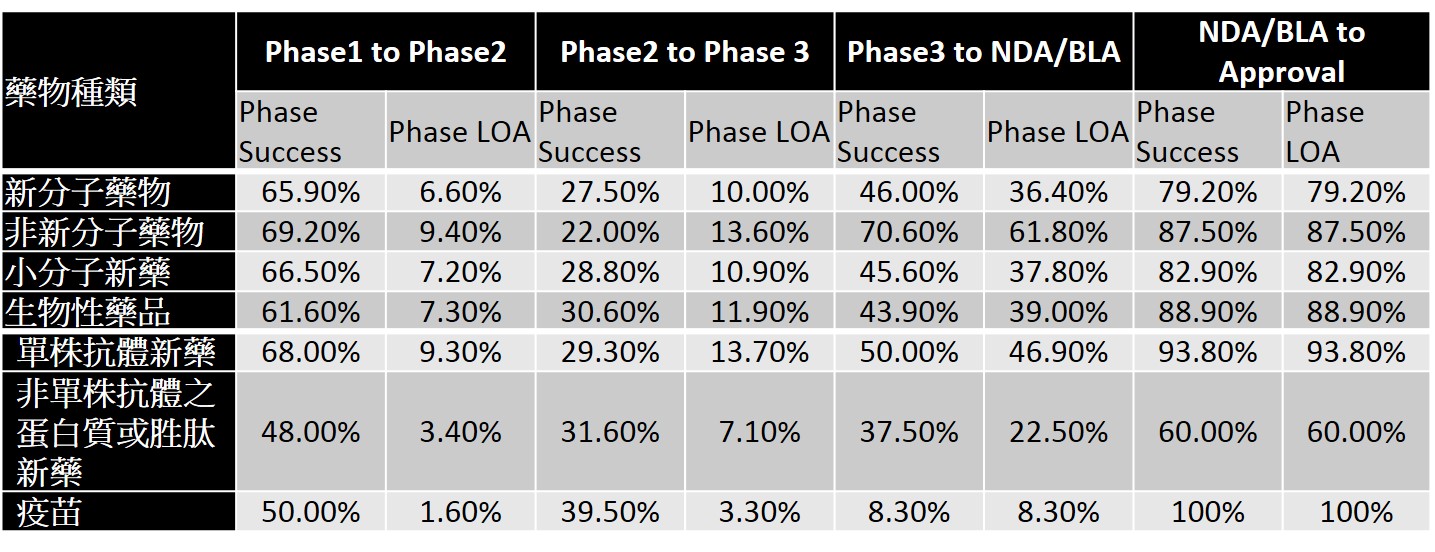
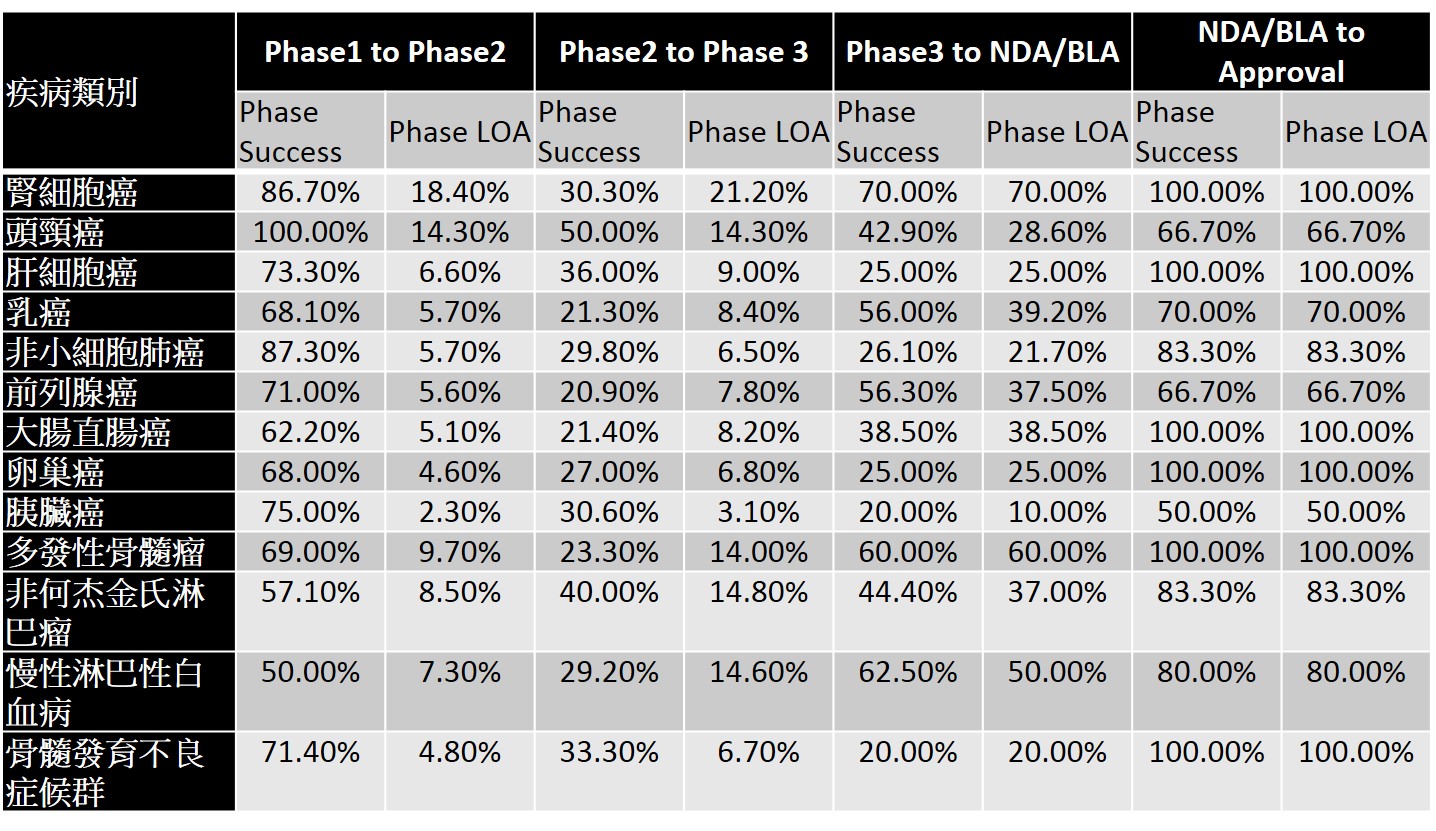
以新藥適應症之大類別觀之,雖然癌症新藥是新藥開發最熱門的領域,約佔全球新藥開發數量約30%,然癌症新藥在臨床各階段的成功機率與最終獲FDA核准通過的機率皆低於其他各類適應症之新藥(表2)。其原因可能跟癌症係屬高度異質性的疾病有關,亦即原先被視為同一類的疾病,實際上依據病因學(etiology)可存在多種亞型,例如以非小細胞肺癌為例,實際上可更進一步區分出至少十種不同基因突變之亞型。進一步觀察癌症新藥的類別,則可以發現單株抗體藥物在各階段普遍而言擁有較高往下一試驗階段與最終獲審查通過的機率(表3)。如將癌症更細分,可以發現腎細胞癌普遍擁有較高往下一試驗階段與最終獲審查通過的機率,相對而言胰臟癌的成功機率則普遍較低(表4)。
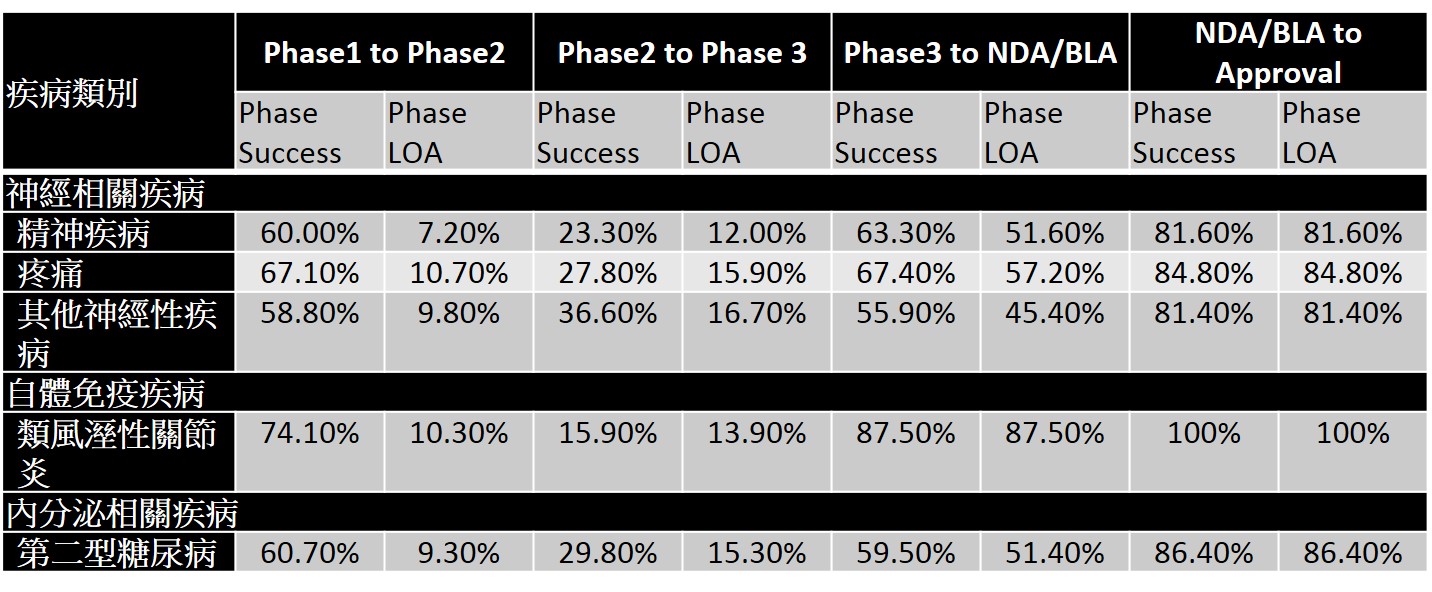
其他也是新藥開發的熱門領域如自體免疫疾病、神經性疾病、內分泌相關疾病等,其新藥開發的成功機率如表5所示。從中可以發現類風濕性關節炎新藥研發至臨床後期,其成功率是相當高的,然在臨床二期的成功率(15.9%)較低。而神經性相關疾病,如精神疾病新藥,在臨床二期的成功率較低(23.3%),以神經退化性疾病為主之其他神經性疾病,則在臨床後期與審查通過的成功率較低(55.9%,81.4%)。
新藥開發的成功率影響因素眾多,近年來全球雖在新藥臨床試驗投入的經費逐漸增加,然法規審查也漸趨嚴格,如在2004年Vioxx因心血管風險而下市事件後,FDA對於藥品安全性的更為要求,此外如癌症常被要求以整體存活期(overall survival)作為臨床試驗評估指標,在臨床試驗設計之交叉試驗(crossover design)中會增加達到良好控制(well-controlled)研究要求之難度,這些要求進一步地增加了臨床試驗設計與執行的困難度,而影響到成功機率。此外,適應症有無良好的臨床試驗評估指標,即與療效直接相關亦為重要因素,例如病毒性感染疾病以病毒定量(viral load)與糖尿病以糖化血色素(HbA1c)為指標,顯示出有較高的臨床試驗成功率。
現有疾病動物模式對於在人體治療安全性與療效的預測能力也是另外會影響臨床試驗成功與否的重要因素之一。而隨著技術的進步,如找出適合的生物標記(biomarker),將病患進行更精確的分群,會有助於臨床試驗成功的機率升高。此外,較小型的藥廠或生技公司可能因資金或藥廠對於開發專案另有在藥物經濟學或產品組合管理等考量、藥廠與法規主管機關之間溝通的良莠等也使得新藥臨床開發會面臨到一些不確定因素。
新藥的臨床試驗,即便在每一個環節都進行良好的評估與設計,仍然無法100%保證成功,因此對於新藥開發各階段與各適應症較為詳細的成功機率訊息可有助於藥廠對藥品開發如在專案管理決策、鑑價、風險評估、藥物經濟學等各面向進行更為詳盡的評估,亦有利於向潛在策略夥伴或外部投資人溝通,使外界對於藥品開發的成功機會有更清楚的認知,以降低資訊之不對稱,增加市場透明度。
(註1)2013醫藥產業年鑑
(註2)Clinical development success rates for investigational drugs, Michael et al.
(註3)Phase2包含Phase I/II, Phase II
(註4)Phase3包含Phase II/III, PhaseIII
(註5)生物性藥品亦可稱為生物製劑、生技藥品等,包含有疫苗、蛋白質藥品(含抗體、酵素、細胞激素、生長激素)、血液純化物(blood isolates)、基因治療、細胞治療等
(註6)Phase success:在特定臨床階段新藥成功發展到下一階段之機率
(註7)Phase LOA:在該階段的新藥,最終獲FDA審查核准上市之機率
文章來源:宇智顧問股份有限公司