美國孤兒藥法案(Orphan Drug Act, ODA)的立法對於製藥公司投入孤兒藥的發展提供了誘因,使得罕見疾病有藥可治。法案的內容包含提供市場獨佔權、臨床試驗的補助、以臨床試驗費用作為稅金抵免、免除藥品審查費用等措施。雖然孤兒藥法案的通過對於投入孤兒藥的開發而言,是一個有吸引力的政策,然為了讓各界可以進一步評估孤兒藥開發的商機,本篇文章將分別從臨床試驗人數、藥品開發時間、藥品開發成本、市場收益、主管機關核准率的角度來探討投入孤兒藥開發的經濟性誘因,以供製藥業者參考。
一、研發成本
罕見疾病因罹病的人數少,故一般孤兒藥的臨床試驗人數亦較少,此外在一些棘手的罕見疾病,主管機關可能在不影響安全性與有效性前提下縮小試驗規模(註3);例如用於治療藍伯-伊頓肌無力症(Lambert-Eaton myasthenic syndrome, LEMS)的amifampridine,其臨床試驗人數為38位病患,而用於治療缺乏N-乙醯穀胺酸合成酶之高血氨症(hyperammonemia associated with N-acetylglutamate synthase deficiency)的carglumic acid,其臨床試驗人數僅為12位病患(註4)。
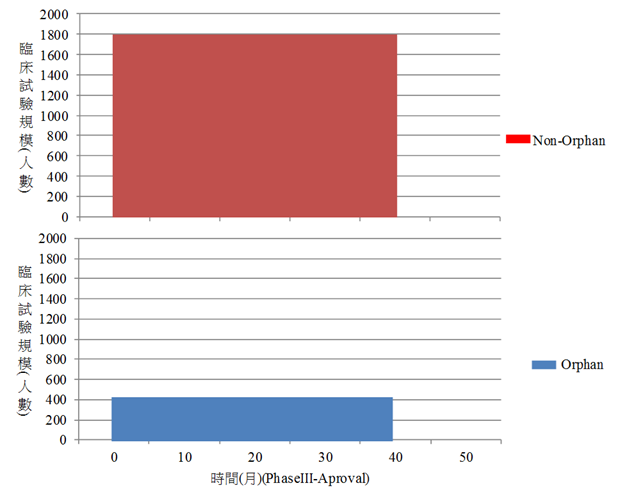
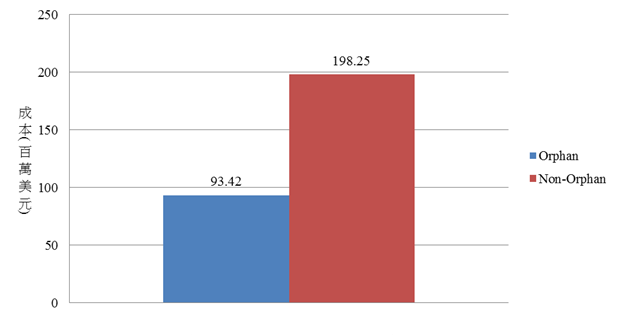
從圖1可知,孤兒藥品臨床試驗三期之規模人數中位數平均約為533人、非孤兒藥品之規模人數中位數平均約為1,863人。而在藥品開發時間的部分,孤兒藥臨床試驗三期到藥品核准時間的中位數平均約為43.5個月,而非孤兒藥品則約為45個月,並無明顯差異。然依據Meekings、Williams與Arrowsmith(2012)(註5)的分析指出從臨床試驗第二期起算孤兒藥品的開發時間約為3.9年,非孤兒藥品則約為5.42年,具顯著差異,推測可能是因為部分藥品的臨床試驗獲得主管機關同意合併或省略部分的試驗;以治療ALK基因異常表現之非小細胞肺癌(ALK+NSCLC)的crizotinib為例,從2005年開始發展出先導化合物(lead compound)到2011年獲得核准,總共藥品開發時間僅6年(註6),其臨床試驗人數僅255人(註7)。因此從上述資料可知,孤兒藥品在試驗招募人數較少與藥品發展時間較短的情形下,其藥品開發成本較低,從圖2可知,孤兒藥品從臨床試驗三期到核准的成本平均約為9,342萬美元,相較於非孤兒藥品的約2億美元低得多。
二、市場收益
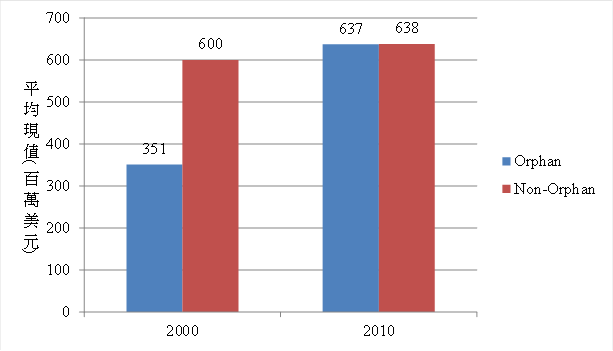
孤兒藥品因其單一適應症的罹病人數不多,一般認為其市場潛力較為受限,然從圖3可知,以2030年為終點的每年藥品預估銷售額回推在2000年與2010年的現值(present value)可看出,平均每款孤兒藥的現值從2000年的3.51億美元成長到2010年的6.37億美元,僅略低於非孤兒藥品的6.38億美元,部分說明了孤兒藥的市場潛力已不低於非孤兒藥,此現象可能與孤兒藥品有較高的定價與採用適應症擴張策略有關。舉例來講,使用eculizumab治療陣發性夜間血紅素尿症(paroxysymal nocturnal hemoglobinuria, PNH)的每劑量費用約6,830~27,320美元(註9),然在美國PNH的病患僅約4,000~6,000人,使得在2010年該藥品營收達約5.4億美元。在適應症擴張部分,總計在2011年至少15%的孤兒藥品有超過一個以上的適應症,而銷售前20大孤兒藥藥品有超過9款藥品的適應症超過一個以上(註10)。進一步以2030年為終點的每年預估銷售額折現到2011年,估計超過一個適應症以上的孤兒藥品平均現值可達343億美元大於單一孤兒藥適應症藥品之81億美元。
三、核准率
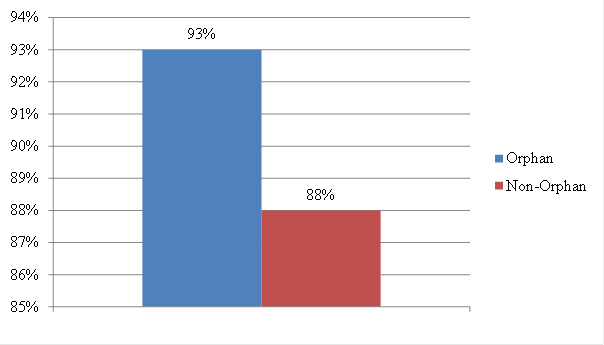
藥品經過長時間的開發,最後能否成功上市的關鍵即在於藥品主管機關的審查,因此通過機率亦為重要的參考因素,從圖4可知,孤兒藥品通過審查的機率為93%高於非孤兒藥品的88%,其可能因罕見疾病缺乏治療方法及致病原因常為單一遺傳性畸變(genetic aberrations)有關。
綜合前述分析可知,相較於非孤兒藥品,孤兒藥有較短的開發時間、較小的臨床試驗規模,使其藥品開發成本較低,而較高的審查通過率,使藥品有更高進入市場的機會,此外亦可能因較高的藥品定價與適應症擴張策略使得孤兒藥擁有不低於非孤兒藥品的市場潛力,再輔以孤兒藥法案所給予的優惠措施與投入高度未被滿足醫療需求之公益形象相信對新藥公司而言,投入孤兒藥的開發會是一個值得投入的方向。
(註1)Orphan Drug Report 2013&2014. EvaluatePharma;數值為中位數
(註2)Orphan Drug Report 2013&2014. EvaluatePharma;數值為中位數
(註3)推動孤兒藥的研發-美國政府正在研議如何讓大型製藥公司保持研製孤兒藥的興趣, 瓦普娜/林慧珍譯(註4)2012 Drug discovery for rare diseases-strategy considerations in developing the orphan drugs of the future. Peter Norman & Mark Lansdell.
(註5)Orphan drug development: an economically viable strategy for biopharma R&D. Meekings, Williams & Arrowsmith
(註6)Crizotinib for ALK-Rearranged Non–Small Cell Lung Cancer: A New Targeted Therapy for a New Target. Gandhi & Janne
(註7)FDA Approval for Crizotinib. National Cancer Institute at the National Institutes of Health
(註8)Orphan drug development: an economically viable strategy for biopharma R&D. Meekings, Williams & Arrowsmith
(註9)Formulary Drug Review- Eculizumab(Soliris). Lewis http://www.pharmacytimes.com/publications/health-system-edition/2013/May2013/Eculizumab-Soliris (最後瀏覽日期2014.03.27)
(註10)FDA(資料統計至2014.02.19);2011年前銷售額前二十大孤兒藥藥品Remicade、Humira、Herceptin、Rituxan、Gleevec、Revlimid、Avonex、Alimta、Velcade、Erbitux、Prograf、Tracleer、Botox、Epogen、NovoSeven、Betaseron、Kogenate、Zometa、Sandostain、Evista;
(註11)Orphan drug development: an economically viable strategy for biopharma R&D. Meekings, Williams & Arrowsmith;經統計檢定具顯著性(P<0.05)
文章來源:宇智顧問股份有限公司