美國的C型肝炎藥物市場的競爭已逐漸進入白熱化的階段,雖然AbbVie的VieKira佔據了Express Scripts,Gilead也不惶多讓佔據CVS Caremark;Express Scripts雖為美國第一大PBM公司,然在C型肝炎的處方簽佔有率與CVS Caremark相較並未有優勢之處。Gilead與AbbVie在美國最大的健康保險計畫之一的Medicaid在各州的給付也各有斬獲,例如全美人口第三大州的德州,並未給付Sovaldi(註1),另在面對AbbVie的競爭下,逐漸開始採用價格競爭以獲得PBM公司或是健康保險給付單位的青睞,例如Gilead宣佈其C型肝炎藥品的折扣平均將達46%(註2)。因著Gilead與AbbVie的C肝藥品在臨床上優異的療效與方面性,可預期C型肝炎藥物的全球市場接下來逐漸主要會由Gilead的Harvoni、Sovaldi與AbbVie的VieKira Pak所盤據,然C肝炎藥物開發競賽尚未中止,各藥廠之間的較力仍持續在進行,我們可由發展中的C型肝炎藥品產品線來一窺端倪及推測市場未來的發展趨勢。
註:1.* Phase II數據 2.**Vaniprevir必需要併用pegIFN與Ribavirin
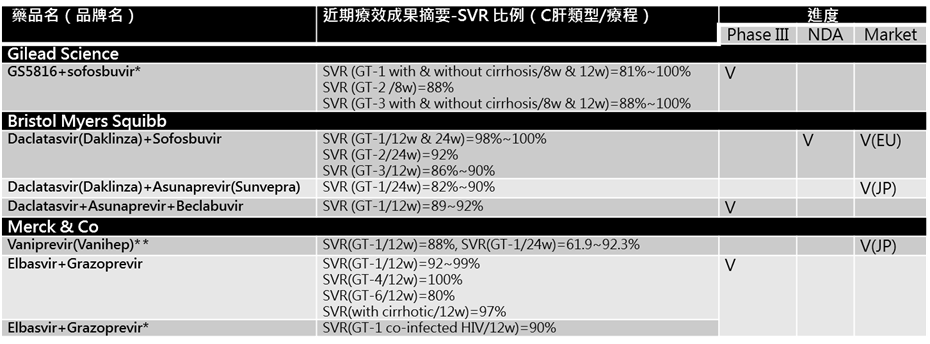
全球C型肝炎藥物產品線發展至臨床三期至甫IND者(在部分國家)舉列如表1所示,可以看出以Gilead、Bristol Myers Squibb與Merck & Co的企圖心最大。Gilead現階段發展至臨床三期的產品為GS5816+ sofosbuvir,該組合療法在臨床二期的試驗中有嘗試較短的療程(8週),然在第1基因型的C型肝炎療效並未有競爭力,而對於第3基因型的療程有潛力從已被核准Sovaldi+ribavirin之24週降低到8-12週(註12)。有鑒於各基因型的C型肝炎未被滿足的醫療需求逐漸降低,Gilead開始朝向縮短療程與其他利基C型肝炎病患族群的治療來發展,例如發展治療腎臟移植病患C型肝炎(註13)、治療C型肝炎病患肝臟移植前後(註14,15)、治療HCV與HIV共感染病患(註16)、將Harvoni治療的族群沿伸至青少年與兒童病患(註17)、治療急型C型肝炎(註18)及具有泛基因型治療潛力的RNA聚合酶抑制劑(GS9857)之組合療法等。
在Bristol Myers Squibb部份,daclatasvir(Daklinza)是第一款在歐洲與日本被核准的NS5A抑制劑,在日本是以和asunaprevir (Sunvepra)的組合療法獲准,短時間可因AbbVie與Gliead的藥物在日本尚未被核准而受益;在歐盟則以和sofosbuvir的組合療法獲准,為sofosbuvir治療第3基因型病患的附加藥物,換言之會略有助於sofosbuvir在第3基因型C型肝炎市場的市佔率,而Bristol Myers Squibb則可藉由sofosbuvir的成功以助於Daklinza被列入C肝治療指引中;而美國FDA在2015年3月亦接受daclatasvir與sofosbuvir對第3基因型之C型肝炎患者之治療的上市申請(註19),預期在第3基因型的C型肝炎藥物市場可望逐步取代Sovaldi+ribavirin而與Gilead的GS5816+ sofosbuvir療法競爭,然不管何種藥物組合療法勝出,最大的獲益者仍為Gilead。Bristol Myers Squibb另一藥物組合療法Daclatasvir+Asunaprevir+Beclabuvir,則療效上相較於並未比Vikkira Pak有顯著的優勢,預期上市後會以價格競爭的方式進入市場。
Merck & Co的部分,Vaniprevir(Vanihep)為NS3蛋白酶抑制劑,在2014年9月獲日本核准治療第1基因型C型肝炎患者,然仍需合併ribaviring與interferon,和現有蛋白酶抑制劑區隔性不高,且尚缺乏和其他interferon-free之合併療法,預期在市場上不易有好的表現。相較於Vanihep ,Elbasvir+Grazoprevir則顯得更具競爭力,因其臨床試驗優異的成效在2013年10月獲得FDA的突破性療法資格認定(breakthrough therapy designation),然其在突破性療法資格認定上並非一路順遂,在今年2月FDA因市場上已有Gilead的Sovaldi與Abbvie的Viekira Pak而取消其資格(註20),而又於今年4月以適應症為第1基因型慢性C型肝炎併接受血液透析治療之腎臟病末期及第4基因型之慢性C型肝炎再獲得突破性療法資格認定(註21)。Elbasvir+Grazoprevir作為interferon-free療法的後進者,面對市場上既有的Sovaldi、Harvoni與VieKira強大對手,Merck & Co亦嘗試將Elbasvir+Grazoprevir的組合療法朝向利基市場努力,除了進行縮短療程的試驗外,其Phase III的試驗亦包含了針對HCV與HIV共感染、C型肝炎併慢性腎臟疾病與第4基因型C型肝炎之病患等。近期Merck & Co在C型肝炎4-6週短療程療法的發展遭逢的挫折(註22),然Merck & Co並未放棄,其在2014年7月併購Idenix,寄望Idenix的研發中C肝藥品IDX21437(NS5B inhibitor /現代號為MK3682)、IDX21459(NS5B inhibitor)可和Merck & Co既有的產品結合發展組合療法來達到縮短療程的目的。
預期C型肝炎藥物的發展會逐漸全面走向直接抗病毒(direct-acting antiviral, DAA)(註23)類型藥品、全口服、免併用干擾素與ribavirin、併用多款藥物之組合療法的方向,對疾病的治療也從疾病控制逐漸走向疾病根除。當藥品治癒率近乎100%時,後進者進入市場的難度將更為困難,剩下的未被滿足醫療需求可能在於難以治療的患者,特別是肝硬化(cirrhotics)、HIV共感染、併慢性腎臟病或年長與年幼者(註24),此外可廣泛用於各基因型之藥物、更短的療程(如4~6週)、肝臟移植或是對抗抗藥性病毒株藥物(註25)也會是接續藥物開發方向的重點。
現今人類在抵抗C型肝炎這種全球流行的傳染病上已經出現相當顯著的進步,在面對許多DAA藥物及全面口服的治療方案指日可待的時代,不同經濟發展水準國家所要面對的課題不同,在已開發國家接續要面對的挑戰是如何提高C型肝炎的篩檢率,而開發中國家則是如何可負擔這些DAA藥物,使國內患者能夠接受這些藥物的治療。不論C型肝炎能否從地球上完全根除,然以公衛的角度來看,接續需要的是這些抗C型肝炎的創新藥物能否以可被負擔的價格供予病患,將會是下一步控制C型肝炎及相關衍生疾病在全球分佈的關鍵。
(註1)Gilead’s $1,000 Pill Is Hard for States to Swallow http://www.wsj.com/articles/gileads-1-000-hep-c-pill-is-hard-for-states-to-swallow-1428525426 (最後瀏覽日期2015/04/20)
(註2)Despite Huge Hep C Drug Sales, Gilead Stock Falls On Forecasted Discounts http://kaiserhealthnews.org/morning-breakout/despite-huge-hep-c-drug-sales-gilead-stock-falls-on-forecasted-discounts/ (最後瀏覽日期2015/04/20)
(註3)Gilead Announces Phase 2 Data for Investigational All-Oral Regimen of Sofosbuvir Plus GS-5816 for the Treatment of Chronic Hepatitis C http://www.gilead.com/news/press-releases/2014/11/gilead-announces-phase-2-data-for-investigational-alloral-regimen-of-sofosbuvir-plus-gs5816-for-the-treatment-of-chronic-hepatitis-c#sthash.LJfDovXs.dpuf (最後瀏覽日期2015/04/20)
(註4)Daclatasvir plus Sofosbuvir for Previously Treated or Untreated Chronic HCV Infection, Mark S et al
(註5)Bristol-Myers Squibb Announces Acceptance of New Drug Application for Investigational Daclatasvir for FDA Review for the Treatment of Hepatitis C Genotype 3 http://news.bms.com/press-release/bristol-myers-squibb-announces-acceptance-new-drug-application-investigational-daclata (最後瀏覽日期2015/04/20)
(註6)All-oral daclatasvir plus asunaprevir for hepatitis C virus genotype 1b: a multinational, phase 3, multicohort study, Manns M et al
(註7)All-oral, fixed-dose combination therapy with daclatasvir/asunaprevir/BMS-791325 for non-cirrhotic patients with chronic HCV genotype 1 infection: UNITY-1 Phase 3 SVR12 results, F. Poordad
(註8)Vaniprevir Plus PegIntron®/Ribavirin in Japanese Participants With Chronic Hepatitis C Who Are Non-responders to Previous Treatment (MK-7009-045) https://clinicaltrials.gov/ct2/show/results/NCT01405560?term=Vaniprevir&rank=9§=X01256#all (最後瀏覽日期2015/04/20)
(註9)Study of Vaniprevir Plus PegIntron®/Ribavirin in Japanese Participants With Chronic Hepatitis C Who Relapsed After Treatment (MK-7009-044) https://clinicaltrials.gov/ct2/show/results/NCT01405937?term=Vaniprevir&rank=8§=X01256#all (最後瀏覽日期2015/04/20)
(註10)Grazoprevir/elbasvir combo shows high cure rate for patients with chronic HCV http://www.medicalnewstoday.com/releases/293016.php (最後瀏覽日期2015/04/20)
(註11)EFFICACY AND SAFETY OF THE ALL-ORAL REGIMEN, MK-5172/MK-8742 +/- RBV FOR 12 WEEKS IN GT1 HCV/HIV CO-INFECTED PATIENTS: THE C-WORTHY STUDY, Mark et al
(註12)Gilead Announces Phase 2 Data for Investigational All-Oral Regimen of Sofosbuvir Plus GS-5816 for the Treatment of Chronic Hepatitis C http://www.gilead.com/news/press-releases/2014/11/gilead-announces-phase-2-data-for-investigational-alloral-regimen-of-sofosbuvir-plus-gs5816-for-the-treatment-of-chronic-hepatitis-c#sthash.WC0o5w5k.dpuf (最後瀏覽日期2015/04/20)
(註13)Safety and Efficacy of Ledipasvir/Sofosbuvir (LDV/SOF) Fixed Dose Combination (FDC) for 12 or 24 Weeks in Kidney Transplant Recipients With Chronic HCV Infection https://clinicaltrials.gov/ct2/show/NCT02251717?term=Ledipasvir&rank=16 (最後瀏覽日期2015/04/20)
(註14)Safety and Efficacy of Ledipasvir/Sofosbuvir Fixed Dose Combination Administered in Patients Infected With Chronic Genotype 1 or 4 HCV for Use in the Peri-Operative Liver Transplantation Setting https://clinicaltrials.gov/ct2/show/NCT02350569?term=Ledipasvir&rank=20 (最後瀏覽日期2015/04/20)
(註15)Ledipasvir/Sofosbuvir Fixed-Dose Combination Plus Ribavirin in Subjects With Chronic HCV With Advanced Liver Disease or Post-Liver Transplant https://clinicaltrials.gov/ct2/show/NCT02010255?term=Ledipasvir&rank=25 (最後瀏覽日期2015/04/20)
(註16)Study of A Combination Pill With GS-7977 and GS-5885 for Hepatitis C in People With HIV https://clinicaltrials.gov/ct2/show/NCT01878799?term=Ledipasvir&rank=23 (最後瀏覽日期2015/04/20)
(註17)Safety and Efficacy of Ledipasvir/Sofosbuvir Fixed Dose Combination in Adolescents and Children With Chronic HCV-Infection https://clinicaltrials.gov/ct2/show/NCT02249182?term=Ledipasvir&rank=30 (最後瀏覽日期2015/04/20)
(註18)HepNet Acute HCV IV – LDV/SOF FDC in Akute Genotype 1 Hepatitis C Virus Infection https://clinicaltrials.gov/ct2/show/NCT02309918?term=Ledipasvir&rank=32 (最後瀏覽日期2015/04/20)
(註19)Bristol-Myers Squibb Announces Acceptance of New Drug Application for Investigational Daclatasvir for FDA Review for the Treatment of Hepatitis C Genotype 3 http://news.bms.com/press-release/bristol-myers-squibb-announces-acceptance-new-drug-application-investigational-daclata (最後瀏覽日期2015/04/20)
(註20)Merck’s loss of HCV Breakthrough status shows FDA’s pragmatism, says analyst http://www.in-pharmatechnologist.com/Regulatory-Safety/MSD-s-loss-of-HCV-Breakthrough-designation-shows-US-FDA-s-pragmatism (最後瀏覽日期2015/04/20)
(註21)FDA grants new breakthrough therapy designations for grazoprevir/elbasvir http://www.healio.com/hepatology/hepatitis-c/news/online/%7B9a1b0106-c598-4a2f-83d2-11419d9fa981%7D/fda-grants-new-breakthrough-therapy-designations-for-grazoprevirelbasvir (最後瀏覽日期2015/04/20)
(註22)SVR(GT-1/4-6w)=39%, SVR(GT-1/8w) =80~87% 資料來源:Merck’s Shortened Hep C Regimens Fall Short of Cure-Rate Goal http://www.thestreet.com/story/12946672/1/mercks-shortened-hep-c-regimens-fall-short-of-cure-rate-goal.html (最後瀏覽日期2015/04/20)
(註23)意指以負責C型肝炎病毒生活史之非結構性蛋白質為標的之藥物,例如蛋白酶抑制劑(protease inhibitor)或RNA聚合酶抑制劑(RNA polymerase inhibitor)等
(註24)All oral HCV therapies near approval, Man Tsuey Tse
(註25)基於HCV高度基因異質性與突變性,以蛋白酶與RNA聚和酶為標的藥物有可能會出現抗藥性,而從藥品標的可以觀察出HCV對該藥品出現抗藥性的機率,ㄧ般而言HCV對聚合酶抑制劑類藥物出現抗藥性的機率較低。資料來源:AbbVie Deal Heralds Changed Landscape for Hepatitis Drugs, Andrew Pollack; Novel therapies for hepatitis C- one pill fits all, Michael P. & Thomas von
文章來源:宇智顧問股份有限公司