美國孤兒藥法案(Orphan Drug Act, ODA)立法已邁入第31年,這法案給了許多過往罹患罕見疾病而無藥可治的人一絲曙光。
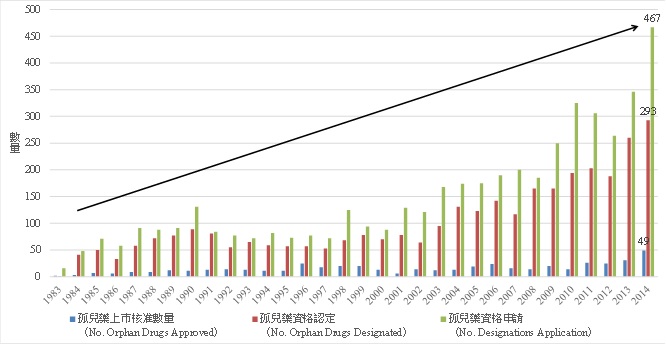
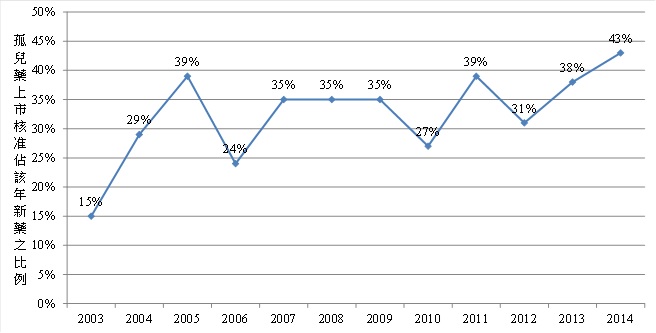
從圖1可以發現,自1983年美國孤兒藥法案立法以來,孤兒藥資格申請、資格認定與上市審查的數量,雖各年會有波動,但整體呈現持續增加的趨勢。在2013年,孤兒藥資格申請件數高達467件、資格認定件數293件、上市核可達49款藥品,這些數據創造出新高的紀錄(圖2);此外法案通過以來至今,合計取得孤兒藥資格認定的藥品佔資格申請者近7成,總計511款孤兒藥獲得新藥審查通過而上市。另一方面,從歷年孤兒藥佔該年新藥的比例可以看出,2003年後即維持相當高的佔比,其中,從2003年到2013年中有8個年度孤兒藥數量佔比更是超過30%,平均佔33%。從上述近年的發展可以看出孤兒藥已是新藥開發的重要方向。
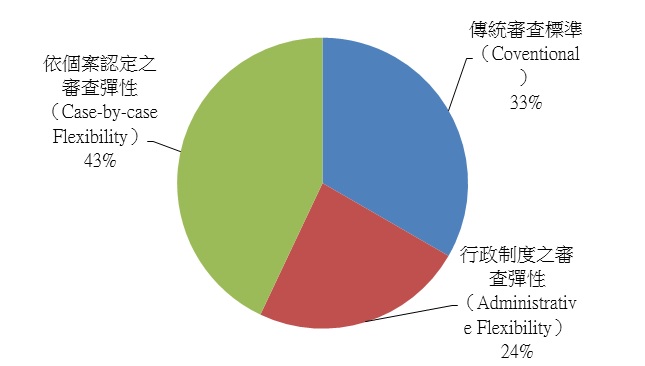
在新藥審查時,主管機關通常會要求藥品的臨床試驗需有2個充分且有良好對照的臨床試驗(the two adequate and well-controlled studies)(註3),來證明藥品的有效性與安全性,而從美國孤兒藥法案的內容來看,其並未特別改變孤兒藥品上市審查的標準,然進一步觀察歷年來孤兒藥上市審查的過程,可發現存在一些藥品審查上的彈性。依據美國罕見疾病組織(National Organization for Rare Disorders, NORD)的研究指出非癌症之小分子孤兒藥品上市審查過程,有33%依循傳統的標準、24%享有行政制度之審查彈性(administrative flexibility)(註4)、43%則為依個案認定之審查彈性(case-by-case flexibility),總計約近7成的孤兒藥上市審查在實務上是透過具彈性的審查過程而獲准(圖3)。從上述可知美國食品藥物管理局(FDA)對於重大未被滿足醫療需求領域與突破性之療法會有較佳的審查彈性,也就是當這些新藥對於罹患罕見疾病的人而言是非常重要甚至是唯一可能的治療方式時,即便未達常見疾病藥物的臨床試驗設計之要求,仍有取得上市核准的機會。
孤兒藥的研究與開發所需的資源是相當寶貴的,尤其是願意參與在臨床試驗的病人彌足珍貴,因相較於常見疾病的藥物,孤兒藥能從動物試驗與早期臨床試驗所取得關於藥品安全性與藥效的資訊較少。因此孤兒藥品的臨床試驗要付諸實行時,在不同相關團體間意見不容易一致,即使對FDA而言,要允許彈性的試驗設計與彈性解釋試驗的結果亦會是個挑戰。
美國的孤兒藥法案立法以來,開啟了新領域的商機,成功的引導產業發展,現已經超過兩百種不同罕見疾病有藥可治療,嘉惠許多病人與其家屬。綜合上述,孤兒藥的開發已成為新藥開發的顯學,而FDA在藥品上市審查所展現出的彈性,像是透過行政制度上如加速審查或依個案認定之彈性,不只造福罕見疾病病患,也促進整體製藥產業投入開發的意願。對於台灣藥品開發業者而言,投入孤兒藥開發,因較低的藥品發展成本與較高取得彈性審查優惠之機會,會適合資源有限的台灣,另基於罕見疾病之高度未被滿足醫療需求的特性與立法國家給予市場獨佔權的優惠,亦有助於台灣藥品在國際市場的拓展;此外在面對開發出重磅型(blockbuster)藥物越趨困難與多款藥物面臨專利懸崖(patent cliff)的今天,跨國大型製藥公司積極尋找補強其產品線的標的,基於孤兒藥具備不容輕忽的市場潛力,這會是台灣建立新藥開發模式的契機。
(註1)The 2014 Numbers Are In: FDA’s Orphan Drug Program Shatters Records, Kurt R. Karst
(註2)New Drug Approval Report 2013, HBM;Trends in New Drug Approvals by US FDA, HBM;Novel New Drugs 2014 Summary, FDA CDER;數據排除診斷型新藥
(註3)Quantum of Effectiveness Evidence in FDA’s Approval of Orphan Drugs, Frank J. Sasinowski
(註4)管理制度的審查彈性(administrative flexibility),包含有加速審查(accelerated approval)與九種情境下可只需要一個設計良好具對照組之臨床試驗(one adequate and well-controlled study and confirmatory evidence)。加速審查規範於Subpart H regulation(21 C.F.R. Part314);九種情境原則則在FDA於1998發表的guidance之“Providing Clinical Evidence of Effectiveness”篇章中描述
(註5)Quantum of Effectiveness Evidence in FDA’s Approval of Orphan Drugs, Frank J. Sasinowski;樣品為1983~2010年7月30日之間135款非癌症小分子孤兒藥品
文章來源:宇智顧問股份有限公司