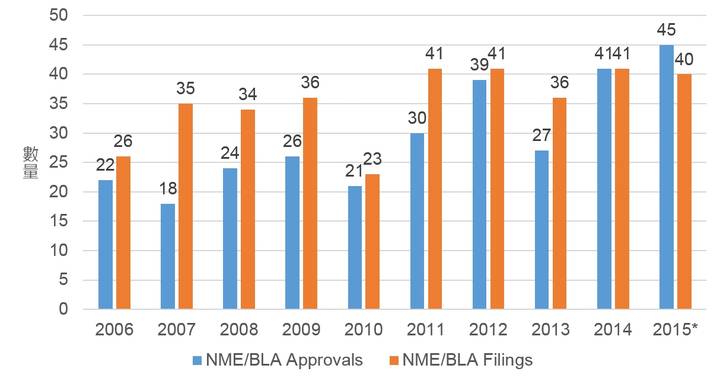
2015年對於新藥開發業者而言是令人振奮的一年,美國FDA共核准了45款新藥(圖1),創下自1996年來核准53款新藥以來的第二高峰,以下將就2015年美國FDA新藥核准的各樣數據來一窺美國FDA新藥審查的最新現況。
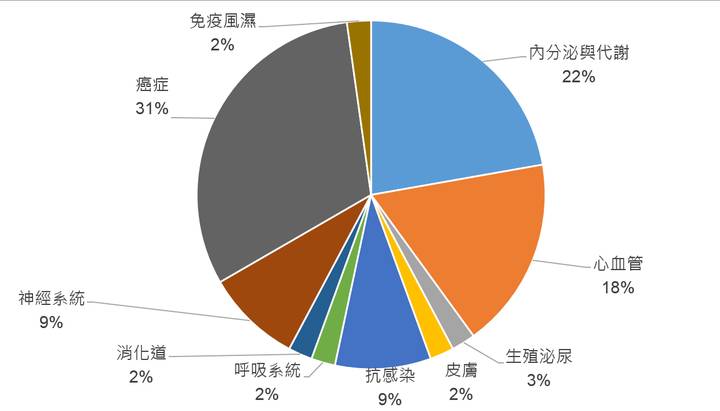
2015年美國FDA核准的新藥適應症領域以癌症用藥最多,有14款藥物(佔31%),其次為內分泌與代謝用藥,有10款藥物(佔22%),次之為心血管用藥,有8款藥物(佔18%)(圖2),從中可以看出癌症、內分泌與代謝與心血管疾病為現今全球新藥開發的主要領域,而抗感染與神經系統藥物亦為重點領域。
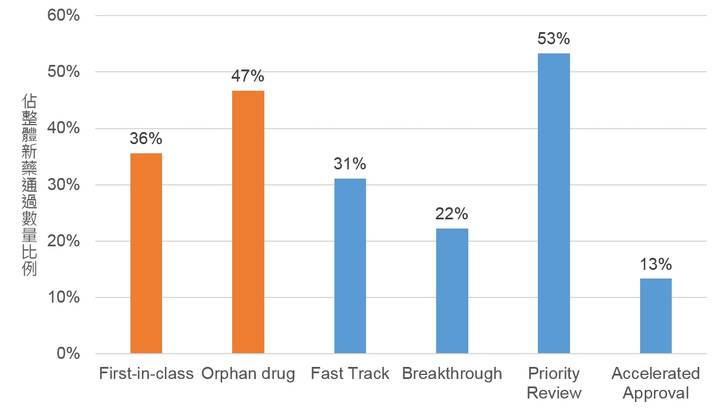
2015年美國FDA所通過的新藥中,有16款(佔36%)為First-in-class之新藥,有21款(佔47%)為具孤兒藥資格(orphan drug designation)之新藥。美國FDA為了加速藥物的審核,讓優質藥物可以加快上市而建立「嚴重疾病用藥加速計畫(Expedited Programs for Serious Conditions)」,其中含四種方案,需經FDA審查通過獲得方案資格者,方能獲得各方案所給所予之優惠。2015年美國FDA通過之新藥有獲Fast Track有14款(佔31%)、Breakthrough有10款(佔22%)、Priority Review有24款(佔53%)、Accelerated Approval有6款(佔13%)(圖3)。總體來看,有27款(佔60%)藥物採用嚴重疾病用藥加速計畫之方案,其中獲得兩種方案資格以上的藥物有27款(佔60%),可以顯見善用嚴重疾病用藥加速計畫是新藥開發與上市審查策略的重要一環。
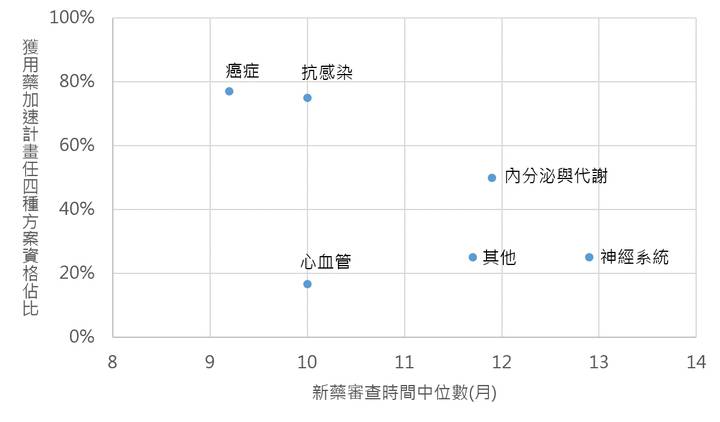
更進一步來看,嚴重疾病用藥加速計畫的四種方案對新藥審查的實質誘因,從2015年美國FDA新藥數據來看(圖4),癌症新藥與抗感染用藥獲嚴重疾病用藥加速計畫中任四種路徑資格的比例偏高,審查長度中位數約在10個月份以下,而心血管疾病、內分泌與代謝疾病、神經系統及其他領域之新藥未獲得「嚴重疾病用藥加速計畫」任四種方案資格的比例較高,約50%以上,其中以神經系統、內分泌與代謝、及其他領域新藥的審查時間較長,審查長度中位數超過11個月份。另從整體來看,未獲資格與有獲任一資格之審查時間平均值(11月vs 10.7月)與中位數(12.1月vs 11.1月)來看,有獲任一資格之審時間略短。從上述可知,單從審查時間來看,嚴重疾病用藥加速計畫對於加快新藥審查時間略有助益。然除了時間之外,嚴重疾病用藥加速計畫依據方案的不同,新藥開發商可與美國FDA有數次關於臨床試驗設計、新藥查驗登記(NDA/BLA)送件前會議(Pre-Submission Meeting),讓廠商可與美國FDA之間充分溝通並了解美國FDA的觀點與考量,這些對於新藥開發大有助益。
從2014核准的41款新藥到2015年以來連續兩年超過40款新藥的核准量,是否足以說明全球新藥開發已一掃先前創新不足的陰霾?然進一步來看,針對罕見疾病之孤兒藥新藥的核准數量自2013年來持續攀升,這顯示出在新藥開發創新能力提升之外更多的是新藥開發方向策略的演進,以醫療需求尚未滿足程度較高的疾病領域為重點開發方向,又或者將較大族群的適應症以新的分子標記或病理表現將疾病做更細部的分群的孤兒藥策略,藉此凸顯出該族群未滿足的醫療需求,而獲用藥加速計畫方案資格之新藥比例高亦呼應了此策略。綜合言之,新藥通過數量的升高,不僅意味著許多尚待新治療方法的疾病有機會獲得更有效的治療,對於製藥廠商而言,其新藥開發的投入獲得回報的機會提升,將激勵眾多的新藥開發業者與新進入者投入,在預期進入市場的機率提升下,投資界亦有機會更樂於挹注資金在新藥開發上,推動整個產業發展更加活絡。
(註1)2015年NDA/BLA filing的數量為40,包含當年的新藥申請案與尚在審查中的案件
(註2)其他領域係指生殖泌尿、皮膚、呼吸系統、消化道之新藥,在2015年各僅有一款新藥
(註3)本圖計算並不包含Corlanor、Entresto、Zurampic、Alecensa這四款藥物,原因為FDA並無揭露這四款藥物之申請日期
(註4)本篇文章數據來源皆為美國FDA
文章來源:宇智顧問股份有限公司